|
УДК 551.481 |
|
|
Некоторые особенности поведения пластиковых микрочастиц (микропластика) в природных водах |
|
|
ФГБУН Институт водных проблем РАН, г. Москва, Российская Федерация e-mail: kazm@iwp.ru |
|
Аннотация. Выявлен ряд особенностей поведения пластиковых микрочастиц в природных водах и проанализированы возможные механизмы, обуславливающие это поведение. Установлено, что частицы из полиэтилена, исходная плотность которого меньше плотности воды, уже через 15-47 часов нахождения на ее поверхности, начинают погружаться в толщу воды, в результате присоединения минеральных и органических частиц, находящихся в природных водах. Микрохлопья из полиэтилентерефталата, имеющие плотность выше плотности воды, могут длительное время находиться на ее поверхности, поддерживаемые силами поверхностного натяжения.
Ключевые слова: микропластик, водный объект, поведение, эксперимент, полиэтилен, полиэтилентерефталат, пенополистирол
Введение
Повсеместное использование пластмассовых изделий, как для производственных, так и для бытовых нужд, относительная дешевизна, легкость производства и обработки пластмасс, возможность изменять их физические и потребительские свойства, привели к тому, что этот материал стал одним из самых востребованных в жизни современного общества. Вместе с тем, обширное применение пластмассовых изделий, многие из которых имеют короткий период эксплуатации или разовое использование, длительный период естественной деградации синтетических полимеров, серьезные трудности и дороговизна вторичной переработки пластмасс стали причинами огромного количества бытового и промышленного пластикового мусора. Даже в первичном виде этот мусор сам по себе является опасным для окружающей среды, а, разрушаясь, его опасность возрастает во много раз.
Микропластик – часть жизненного цикла изделий из пластика, возможно самая длинная по времени, самая масштабная по глобальному распространению, разнообразию, мобильности и степени загрязнения всех природных сред. Это стойкий (период распада может длиться тысячи лет), биоаккумулятивный (обнаружен практически во всех биологических системах, органах и крови человека), токсичный загрязнитель, способный вызывать патогенные изменения в организмах в результате выщелачивания присутствующих в пластиковых предметах добавок, процессов сорбции-десорбции и переноса большого количества и спектра опасных загрязняющих веществ, а также патогенных микроорганизмов [1]. Пластиковые микрочастицы обнаружены практически везде: в воздухе, почвах, в воде внутренних водоемов и Мирового океана, на пляжах и в донных отложениях глубоководных частей морей и океанов, в снеге и горных ледниках. Микропластик обнаружен в питьевой воде и продуктах питания, и не только в морепродуктах, таких как моллюски, крабы, рыба, но и в соли, меде и даже в пиве. Есть опасения, что наряду с другими новыми и мало изученными проблемами охраны окружающей среды, загрязнение микропластиком может повлиять на глобальное сохранение биологического разнообразия [2].
Широкомасштабные исследования по этой проблеме начали проводиться только в последнее десятилетие и, хотя за эти годы число публикаций возросло в мире на порядок и с каждым годом удваивается, здесь все еще больше вопросов, чем ответов. Есть сомнения даже в том, правильно ли поставлены вопросы. Ясно одно, эти маленькие частицы могут вызвать большие последствия планетарного масштаба. Глобальность и важность предотвращения загрязнения окружающей среды пластиковыми отходами была документирована в 2022 году Ассамблей ООН по окружающей среде (ЮНЕА), которая приняла решение о разработке «имеющего обязательную юридическую силу международного договора» о борьбе с загрязнением пластмассами, в том числе морской среды.
Загрязнению окружающей среды микропластиком в настоящее время посвящено более 5 тысяч работ, однако мало что известно об источниках пластиковых микрочастиц, их поведении в водных объектах и конечной судьбе. Кроме того, несмотря на то, что пластиковые микрочастицы объединены общим названием микропластик, их свойства, поведение в водной среде и конечная судьба чрезвычайно различны, что определяется, как самой полимерной матрицей, так и множеством добавок и наполнителей, а также условиями и временем пребывания в окружающей среде.
Плотность большинства полимерных материалов близка к плотности воды. Это значит, что частицы, плотность которых меньше плотности вод, должны плавать на ее поверхности, а частицы с плотностью выше плотности воды, должны опускаться на дно. В реальных же природных условиях микропластики на базе полимеров низкой плотности встречаются в донных отложениях окраинных морей [3] и на дне океанических глубин [4, 5]. С другой стороны, на поверхности воды встречаются микрочастицы пластика из полистирола, поливинилхлорида и полиэтилентерефталата, обычная плотность которых выше плотности воды [6].
Предполагается, что одной из причин опускания на дно легких пластиковых микрочастиц может быть изменение их плотности в результате роста сообществ биообрастания на поверхности и в микротрещинах частиц, включая микроорганизмы и планктон [7-9]. Биообрастание увеличивается в летний период [10]. Кроме того, эксперименты в природных условиях показали, что при опускании частиц в более глубокие слои биообрастание резко снижается, что создает условия возврата микропластиков в верхние слои или на поверхность океана [11]. На предположении о возникновении на поверхности пластиковых микрочастиц биопленок базируется теоретическая модель, позволяющая имитировать влияние роста биообрастания на судьбу микропластика [12]. Вместе с тем, по разным оценкам, для полиэтилена скорость биообрастания изменяется от 2-4 недель (натурный эксперимент с полосками) [13] до 6-8 месяцев (численные расчеты для микроволокон) [14]. Гипотетические расчёты увеличения плотности полиэтиленовых микрочастиц показывают, что сферические частицы до погружения из-за биообрастания могут проводить в эвфотической зоне и удерживаться на поверхности воды до 10-15 лет [14].
Другая возможная причина существенного изменения плотности пластиковых микрочастиц, влияющая на их поведение – агрегация и флокуляция с органическими и неорганическими частицами. Учитывая высокие концентрации взвешенных частиц, особенно частиц детрита в прибрежной зоне, агрегирование и последующее осаждение может доминировать в судьбе и пространственной дифференциации микропластиков. Модельные исследования, показали, что дополнительная масса взвешенных частиц каолина или бентонитовой глины, которые формировали гетероагрегаты с микропластиками, превалировала над вариациями плотности частиц и формированием биопленки в качестве основного процесса, контролирующего судьбу и удержание на поверхности воды микропластиков [15]. Аналогичные экспериментальные результаты получены для фрагментов и нитей из поливинилхлорида в размерном диапазоне 63-125 мкм, которые легко флокулировали с мелкозернистым природным частицами в естественных концентрациях, и затем в агрегатах оседали значительно быстрее, чем отдельные частицы [16]. В другом эксперименте с экспонированием частиц из полиэтилена, полиэтилентерефталата и полистирола в эпи-, мета- и гиполимнионе пресноводного водоема в конце лета в течение 47 дней установлено, что независимо от толщины биопленки и состава бактерий, цианобактерий и водорослей, частицы полиэтилена оставались плавучими, а скорость опускания частиц полистирола и полиэтилентерефталата не изменилась. Во время эксперимента произошло событие, вызвавшее смешение воды из гиполимниона, богатой неорганическими частицами из оксида железа, с водой из верхних слоев. Это побудило агрегацию и погружение частиц полиэтилена вместе с органическим веществом, колониями цианобактерий и минералами железа [17]. Вместе с тем, установлено, что агрегация, приводящая к увеличению плотности частиц, сильно зависит от вида полимера [18, 19] и среды нахождения частиц [20].
Не менее сложными и практически не изученными являются вопросы динамики пластиковых микрочастиц под действием гидродинамической активности водных масс и воздействия ветра на поверхность воды и сами частицы, а также при наличии в прибрежной зоне высшей водной растительности. Отсутствуют или недостаточно знаний о поведении микрочастиц с учетом многообразия их форм, в частности, для частиц в виде микроплёнок и микрохлопьев. Не установлены различия в их поведении в сравнении с другими видами микрочастиц, например, микрофрагментами, состоящими из одной и той же полимерной матрицы. Нет однозначного ответа на вопрос, почему пластиковые микрочастицы с полимерной матрицей тяжелее воды, обнаруживаются на ее поверхности или всплывают, а частицы из материала легче воды, наоборот, опускаются на дно, сколько времени необходимо для того, чтобы микрочастицы в виде микропленок начали погружаться в воду и какие факторы этому способствуют.
Целью данной работы является анализ поведения пластиковых микрочастиц из полиэтилена высокой плотности, полиэтилентерефталата, пенополистирола и полиэстера, находящихся в природных водах в виде микропленок, нерегулярных микрофрагментов, микрохлопьев, микросфер и микроволокон, а также возможных причин их нахождения на поверхности воды, в ее толще и на дне. Исследования проводились путем проведения натурных и лабораторных экспериментов в присутствии высшей водной растительности и без нее.
Материалы и методы
Поведение пластиковых микрочастиц изучалось во время натурных экспериментов на Иваньковском водохранилище и в лабораторных сосудах. Характеристики исследуемых микрочастиц приведены в таблице. Во время натурных экспериментов на исследуемых участках измерялись глубина и скорость течения воды, высота, длина и частота ветровых и судовых волн, определялись уклон дна и тип донных отложений, количество растений на 1 м2 акватории и их диаметр, проективное покрытие макрофитов, ежедневно фиксировалась скорость и направление ветра, наличие или отсутствие дождя. Подсчитывалось количество частиц микропластика, находящихся на каждом метре от уреза воды и их положение: плавают на поверхности воды, опустились на дно или прикрепились к растениям. Более подробное описание видового состава присутствующей высшей водной растительности и ее влияние на динамику исследованных пластиковых микрочастиц дано в работе [21].
Таблица 1
Характеристики исследованных пластиковых микрочастиц
|
Базовый полимер |
Вид, форма частиц |
Средний размер, мм |
Плотность, г/см3 |
Средний вес, мг |
|
Полиэтилен высокой плотности |
Микропленки в форме полосок и квадратов, фрагменты нерегулярной формы |
1,0; 2,0; 4,5 |
0,89-0,97 |
1,1 |
|
Полистирол |
Пластины квадратной формы |
1,0 |
1,04-1,10 |
1,0 |
|
Пенополистирол |
Микросферы |
1,0; 3,0; 4,5 |
0,01-0,04 |
0,4 |
|
Полиэтилен-терефталат |
Микрохлопья нерегулярной формы |
4,3 |
0,96-1,45 |
1,8 |
|
Полиэстер |
Микронити, микроволокна |
2,5 |
1,24-2,30 |
0,3 |
Составлено автором.
Глубина воды и параметры волн измерялись штангой-рейкой ГР-56М. Скорость течения воды измерялась гидрометрической вертушкой ИСП с миликрыльчаткой и притопленными поплавками. Скорость ветра – ручным индукционным анемометром АРИ-49. Тип донных отложений и проективное покрытие макрофитов определялись визуально. Опыты проводились при высоте волн в прибрежной зоне 3,5-6,5 см, их длине 1,5-4,2 м и частоте 0,25-0,50 1/с. За время наблюдений скорость ветра изменялась от полного штиля до 16 м/с. Периодичность измерений зависела от особенностей участка и погодных условий и колебалась от ежедневных до одного раза в неделю.
Лабораторные опыты выполнялись в сосудах объемом 5 л, в которые помещалось фиксированное количество пластиковых микрочастиц и срезанные на водоеме растения или их фрагменты. Отдельным вопросом было исключение или минимизация влияния стенок, так как пластиковые микрочастицы имеют хорошую способность прилипать к стенкам стеклянных сосудов или даже ползти по ним вертикально вверх. Это особенно характерно для частиц полистирола, плотность которого немного выше плотности воды, и частицы которого, в зависимости от концентрации и размера, могут не полностью рассеиваются в воде [22], а также для легких частиц пенополистирола. Способность частиц пенополистирола подниматься по стенкам стеклянных сосудов (даже сухим) делает крайне затруднительным проведение лабораторных экспериментов.
Концентрация микрочастиц в лабораторных сосудах помещалась в количестве эквивалентном 50, 500, 1000, 3000 и 6000 шт./м2. Концентрация частиц 500 шт./м2 была принята как основная и наиболее вероятная, поскольку является верхним пределом обнаруживаемого в настоящее время уровня загрязнения микропластиком наиболее загрязненных континентальных водных объектов (например, водохранилище Данцзянкоу (Китай) [23]) и соизмерима с концентрациями, используемыми в лабораторных исследованиях, при которых наблюдается негативное воздействие микропластика на биологические объекты [24-26].
Были выполнены серии опытов с микрочастицами различного размера, формы и состава, с однородными характеристиками или в смеси. Состояние растений изменялось от живых, в различной стадии роста, до частично разложившихся, включая искусственно высушенные и отмершие. Кроме естественно спокойного состояния водной среды искусственно создавалось перемешивание воды и волновые движения. Каждый эксперимент в природных и лабораторных условиях повторялся 5-14 раз.
Результаты и обсуждение
В абсолютном большинстве случаев для пластиковых микрочастиц, как и других микрочастиц, обнаруженных в воде или донных отложениях водных объектов, неизвестен источник их происхождения, длительность пребывания в окружающей среде и пути поступления в водный объект. Фрагменты пластиков, прежде, чем попасть в водный объект и собственно стать фрагментами какого-то пластикового изделия, должны достаточно длительное время находиться в сточных водах или на загрязненной территории суши, где присутствуют другие загрязнители. Натурные эксперименты показывают, что даже после формирования микрочастиц при разрушении предметов из синтетических полимерных материалов, находящихся в прибрежной зоне, для попадания этих микрочастиц с суши в водные объекты необходимо от несколько месяцев до нескольких лет [27]. На муниципальных и стихийных свалках всегда имеется значительное количество органического вещества из бытовых отходов. Почвенный гумус, органическое вещество из отходов и глинистые частицы, плотность которых в 2,5-2,7 раза выше, имеют высокую степень адгезии к гидрофобным пластиковым материалам. Поэтому, маловероятно, что пластиковые микрочастицы, находясь в сточных водах или перемещаясь по суше под воздействием водных или воздушных потоков, будут иметь плотность исходного полимера. Поскольку плотность абсолютного большинства органических веществ и минералов значительно выше плотности воды и микропластиков, то даже частицы на основе полиэтиленов и полипропилена, сформировавшие гетероагрегаты, сорбировавшие минеральные частицы или просто загрязненные органическим веществом, попадая в водный объект, вероятнее всего будут погружаться в воду.
Если частицы из полиэтилена не загрязнены на суше за время их формирования из более крупных предметов, они некоторое время плавают по поверхности воды, поскольку плотность этого полимера ниже плотности воды. Кроме того, частицы поддерживаются на поверхности воды силой поверхностного натяжения, величина которой для воды довольно высока по сравнению с другими жидкостями и среди распространенных жидкостей уступает только ртути. Проведенные нами натурные и лабораторные эксперименты показывают, что даже ранее незагрязненные частицы пленок из полиэтилена высокой плотности довольно быстро начинают погружаться в воду. Причина этому наличие в воде и адгезия водного гумуса и взвешенных минеральных частиц, а не биообрастание.
При наличии в лабораторном сосуде высшей водной растительности, перенесенной из естественной среды их произрастания, и, являющейся источником природных микрочастиц и условий перемешивания воды, уже через 24-47 часов более 10 % микропленок из полиэтилена высокой плотности со средним размером 4,5 мм погружается в водную толщу и находятся в ней. Дополнительно, примерно такое же количество микропленок опускается на дно. Более мелкие частицы из того же материала (средний размер около 1 мм) начинают погружаться в воду еще быстрее. Через 15-16 часов около 10 % микрочастиц мелких частиц уже находятся в толще воды, а в присутствии роголистника темно-зеленого (Ceratophyllum demersum L.) эта величина возрастает до 33 %. Со временем процесс опускания микропленок в воду только нарастает (рис. 1). Отмечено, что адгезия природных микрочастиц на частицах микропластика начинается и протекает более интенсивно в местах, где имеются неровности поверхности: изгибы, надрывы, расщепления, царапины, потертости.
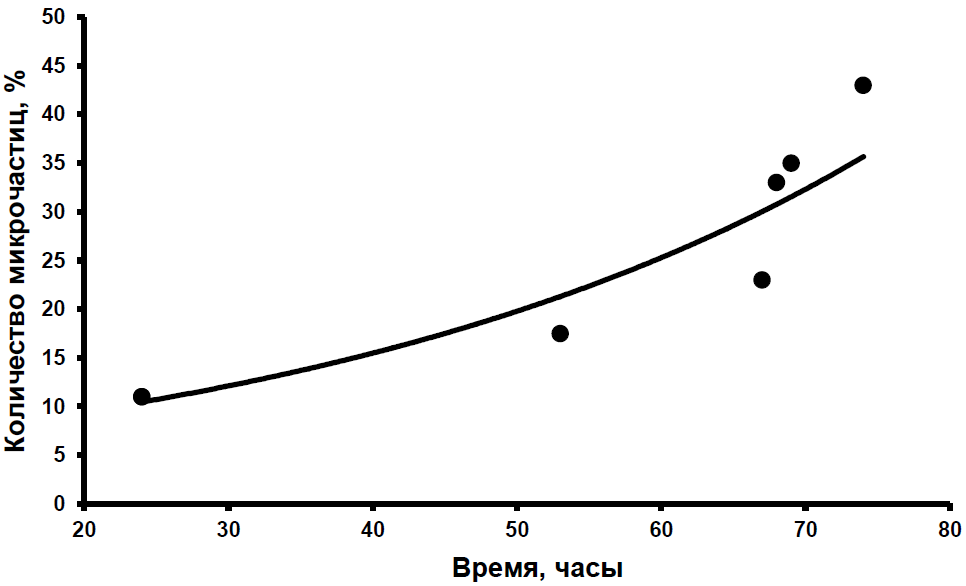
Рис. 1. Изменение во времени количества микропленок из полиэтилена высокой плотности, погружающихся в толщу воды в присутствии макрофитов
Составлено автором
Нами исследовано влияние на погружение в водную толщу микропленок из полиэтилена присутствие в воде тростника обыкновенного (Phragmites communis Trin.), манника большого (Glyceria maxima (Hartm.) Holmb.), аира обыкновенного (Acorus calamus L.), осоки острой (Carex acuta L.), рдеста плавающего (Potamogeton natans L.) и роголистника темно-зеленого. В лабораторных условиях начало и интенсивность погружения микропленок в воду зависит от площади поверхности растений и ее структуры, способствующих удержанию минеральных частиц и частиц водного гумуса. В наших экспериментах быстрее всего осаждение микропленок из полиэтилена высокой плотности начиналось в присутствии растений рдеста плавающего, имеющего большую площадь гладких, плавающих на поверхности воды листьев, хорошо задерживающих взвесь и легко ее отдающих в поверхностный слой воды, где и находятся микропленки. Тоже самое можно сказать о роголистнике темно-зеленом, листья которого хотя и имеют другую структуру, но также эффективно удерживают мелкодисперсные частицы, как на самих листьях, так и в пространстве вокруг них.
Насколько важно существование перемешивания верхнего слоя воды и микрочастиц на растениях в процессе перехода микропленок из полиэтилена высокой плотности в погруженное состояние, показывают результаты проведенного автором эксперимента, когда в сосуд с чистой водопроводной водой осторожно помещались растения осоки и микропленки. Растения осоки были предварительно ополоснуты в водопроводной воде. Микропленки оставались на поверхности воды в течение 170 часов. В последующие 24 часа в воду погрузились 6 % микрочастиц и столько же осело на дно. Отсутствие перемешивания препятствовало смыву микрочастиц с поверхности растений, их дисперсии в воде и адгезии на микропленках, замедляло процессы обмена между растениями и водой, а также усиливало действие сил поверхностного натяжения. После того, как в эксперименте были искусственно созданы условия перемешивания воды, количество микрочастиц в ее толще возросло до 10 %, а еще через 24 часа уже составляло 18 %. В то же самое время количество микропленок, осевших на дно, увеличилось до 38 %.
Полученные нами результаты согласуются с результатами модельных исследований агрегации микропластика с частицами каолина и бентонитовой глины [15] и показывают, что под действием микрочастиц природного происхождения, переход плавающих на поверхности воды микропленок из полиэтилена высокой плотности в погруженное состояние измеряется несколькими днями, что значительно быстрее, чем изменение плотности частиц в результате биообрастания, которое для полиэтилена может изменяться от 2-4 недель [13] до 6-8 месяцев [14].
Следует отметить, что среди изделий из пластика упаковки в виде пленок имеют наибольший объем производства, потребления и разнообразия и, как следствие, составляют основную массу пластиковых отходов (только для упаковок это 141 млн. т или 54 % всех мировых пластиковых отходов в 2015 г. [28]). Кроме того, именно фасовочные пакеты занимают наибольший объем среди упаковочных материалов, а их механическая прочность и срок эксплуатации значительно ниже, чем у других пластиковых предметов.
Сколько времени должны провести на поверхности воды микрофрагменты из полиэтилена, имеющие жесткую структуру, прежде, чем они изменят свою плотность и погрузятся в водную толщу, необходимы дополнительные экспериментальные исследования. Наши натурные и лабораторные эксперименты показывают, что фрагменты из полиэтилена высокой плотности со средним размером 5 мм имеют нейтральную плавучесть, слабо реагируют на интенсивное перемешивание воды (более 90 % частиц остаются на поверхности), не подвержены влиянию ветра и менее подвижны на поверхности воды по сравнению с микропленками из того же материала. Они не тонут по прошествии достаточно длительного времени, измеряемого неделями.
Среди микрочастиц на основе полимерных материалов массового производства, плотность которых выше плотности воды и которые в обычных условиях должны погружаться в воду, нередко встречаются частицы полиэтилентерефталата, основным источником которых являются бутылки для напитков. В результате экспериментальных работ нами установлено, что, несмотря на высокую плотность базового полимера, микрочастицы из полиэтилентерефталата в виде хлопьев могут длительное время находиться на поверхности воды, поддерживаемые силами поверхностного натяжения. Кроме того, поддержанию микрочастиц из полиэтилентерефталата на поверхности воды способствует гидрофобность полимера. Расчеты показывают, что силы поверхностного натяжения могут удерживать частицы, масса которых измеряется единицами граммов. Это значительно выше массы пластиковых микрочастиц, которые обычно обнаруживаются на поверхности воды и масса которых составляет единицы миллиграммов.
На нахождение микрочастиц на основе полиэтилентерефталата на поверхности слабо влияет скорость течения воды и ветро-волновые перемешивание, а плавучесть сохраняется до тех пор, пока не произойдет разрушение поверхностной пленки во время волнения или дождя и заныривание частиц в воду. Этим можно объяснить случаи обнаружения частиц из полиэтилентерефталата на поверхности водных объектов. Во время сильного дождя значительно возрастает вероятность прямого попадания капель в микрочастицы. В результате этого возможен массовый уход пластиковых микрочастиц с поверхности воды. При заныривании под поверхность воды, хлопья полиэтилентерефталата быстро тонут в соответствии с гидравлической крупностью, присущей этим частицам, и достигают дна.
Примерно такое же поведение характерно для микрочастиц полистирола и микроволокон из полиэстера. Хотя полиэстер в полтора раза тяжелее полиэтилентерефталата, но, из-за своих размеров, микроволокна из него одни из самых легких среди крупных микрочастиц, встречающихся в окружающей среде. Благодаря этому, микроволокна дольше удерживаются на поверхности воды, даже в ветреную погоду, длительное время находятся в толще воды и медленнее опускаются на дно, что влияет на скорость и уровень загрязнения микропластиком разных компонентов водной экосистемы.
Поддержание тяжелых микрочастиц в толще воды и даже достижение ими водной поверхности возможно не только благодаря турбулентному перемешиванию водных масс, но и по причине газообмена в водной экосистеме. Ранее было высказано предположение, что пластиковые микрочастицы могут всплывать из-за подъема пузырьков газов, выходящих из донных отложений [29]. То, что такой механизм возможен, свидетельствует принцип работы установок отмучивания для разделения разных частиц, в том числе микропластика, по их размеру, форме и плотности [30].
В лабораторных условиях нами наблюдались случаи, когда микрохлопья из полиэтилентерефталата, ранее осевшие на дно, обратно всплывали на поверхность воды. Это происходило, когда в сосуде находились растения, на поверхности которых формировались пузырьки газов или после интенсивного перемешивания. Такие же пузырьки газов, особенно в светлое время суток, формировались на гранях микрохлопьев и, в значительно меньшем количестве, на их верхней плоскости (рис. 2). Средний диаметр пузырьков около 0,5 мм. При неоднородном распределении пузырьков на разных гранях частиц, грань, на которой пузырьков больше, приподнимается над дном, частица какое-то время находится в вертикальной плоскости, а затем всплывает на поверхность. Всплыванию также способствует минимальное гидравлическое сопротивление при расположении частицы вертикально и уменьшение гидростатического давления. При отрыве частицы от дна скорость ее всплывания составляет около 0,03 см/c. Достигнув поверхности воды, пузырьки газов частично схлопываются, но микрочастица остается на поверхности воды, поддерживаемая архимедовой силой, силой поверхностного натяжения и, какое-то время, оставшимися прикрепленными пузырьками. Крупные частицы с длиной граней 5 мм и более, имея большой вес, всплывают реже и позже более мелких частиц.
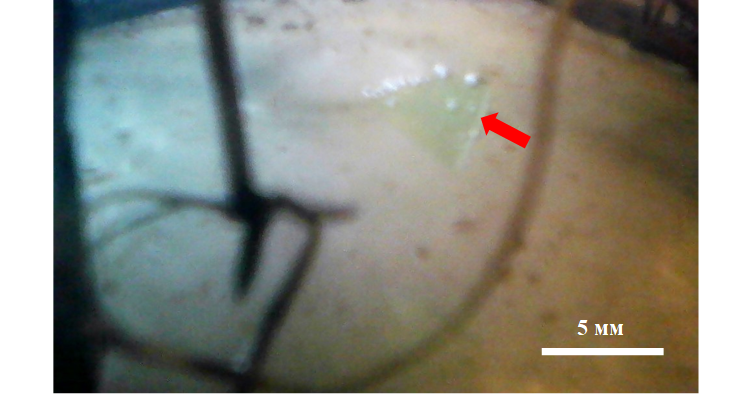
Рис. 2. Микрочастица полиэтилентерефталата с прикрепленными микропузырьками газа в лабораторном сосуде
Фото автора
Кроме веса, удержанию частиц на дне способствуют силы адгезии. На микрохлопьях из полиэтилентерефталата, плотно прилегающих к поверхности дна, пузырьки газов не формируются или формируются в значительно меньшем количестве и меньшего размера. Некоторые микрохлопья с прикрепленными пузырьками газов не всплывают на поверхность, но, в отличие от частиц без пузырьков, находясь в вертикальном положении, легко перемещаются по дну путем сдвига и сальтации во время повышенной гидродинамической активности в придонной области. Кроме того, повышенная гидродинамическая активность приводит к отрыву пузырьков газов от поверхностей твердых предметов, находящихся в воде, и их всплыванию, создавая условия, подобные отмучиванию. Нами также наблюдались единичные случаи всплывания микрохлопьев полиэтилентерефталата без видимых пузырьков газов на их поверхности. По-видимому, в этом случае изменение плотности микрочастиц происходило в результате адсорбции газов их поверхностью.
Не менее сложна динамика и миграция пластиковых микрочастиц в виде микросфер из пенополистирола, попавших в водный объект, источником которых являются различного рода упаковки. Кроме уже упомянутого разнообразия свойств плавучести, существует еще целый ряд факторов, влияющих на поведения и судьбу микрочастиц в каждом конкретном случае. Характерной особенностью микрочастиц из пенополистирола является их высокая парусность, способная внести существенный вклад в скорость их миграции. Эти чрезвычайно легкие сферические частицы, имея высокую парусность, не плывут, а котятся по водной поверхности и способны за сутки преодолеть расстояние около 250 км, то есть пересечь Балтийское море [14].
Микрочастицы из пенополистирола легко сдуваются с суши в ветреную погоду и, на первый взгляд было бы логично предположить, что, чем сильнее ветер, тем больше микрочастиц попадет в водный объект. В некоторых случаях так и происходит. Например, когда сдутые частицы попадают в закрытый от ветрового волнения залив или, когда скорость ветра достаточна для переноса легких частиц из пенополистирола, но недостаточна для развития ветровых волн, а также, когда эти частицы прикрепились к более крупным предметам, плавающим или находящимся неподвижно на поверхности воды. Такое прикрепление и удержание микрочастиц из пенополистирола возможно в результате взаимодействия электрических полей [31]. В противном случае, около 80 % частиц ветровыми волнами выбрасывается обратно на сушу при их максимальном вертикальном заплеске, где эти частицы и остаются, смешанные с другим, выбрасываемым на берег, мусором и прикрытые им. Из такого состояния частицы пенополистирола уже значительно позже попадут в водный объект, если не будут депонированы и захоронены под слоем минеральных частиц. Только около 20 % микрочастиц из пенополистирола остаются в водном объекте в условиях развитого ветрового волнения в прибрежной зоне и береговом источнике их поступления. Такая пространственная дифференциация частиц пенополистирола сохраняется и при наличии полосы зарослей тростника на удалении около 5 м от уреза воды.
Если источник микрочастиц из пенополистирола находится в водном объекте на некотором удалении от берега, происходит быстрое рассеивание частиц по акватории. Такая ситуация складывается, когда крупный предмет из пенополистирола попал в водный объект и там разрушается. В условиях зарослей манника с проективным покрытием 80 % при нагонном ветре около 7 м/с, высоте волн у берега 6 см и скорости приповерхностного стокового течения 1-2 см/с, частицы из пенополистирола со средним диаметром 4,5 мм, одновременно вышедшие из точечного источника, уже через 1 мин. рассеиваются на площади 1 м2, а через 5 мин. занимают площадь 6 м2. Движение частиц пенополистирола на поверхности воды определяется сложным взаимодействием факторов в контактной зоне на границе между водой и воздухом. Поскольку микрочастицы очень легкие и практически не погружаются в воду, поддерживаемые в том числе силами поверхностного натяжения, их движение определяется не только перемещением воды в верхнем миллиметровом слое, но и поступательным движением и микровихрями воздуха.
Выводы
Хотя микрочастицы синтетических полимерных материалов, встречающиеся в окружающей среде объединены под общим термином микропластик, существует большое разнообразие их размеров, форм, видов базовых полимеров, степени выветривания, определяющие их поведение в водных объектах. Установлено, что для погружения в воду микропленок из полиэтилена высокой плотности достаточно нескольких дней. Не загрязненные микрочастицы этого вида в размерном диапазоне 1-4,5 мм через 15-47 часов нахождения на поверхности воды начинают погружаться в водную толщу. Основной причиной этого погружения является агрегация микропленок с минеральными и органическими частицами, находящимися в природной воде.
Микрохлопья из полиэтилентерефталата, имеющие плотность выше плотности воды, могут длительное время находиться на ее поверхности, поддерживаемые силами поверхностного натяжения. Кроме того, возможно всплывание микрочастиц из полиэтилентерефталата в результате присоединения к ним микропузырьков газов. Скорость всплывания составляет около 0,3 см/с.
Динамика и конечная судьба микрочастиц из пенополистирола в прибрежной зоне водного объекта зависит от целого ряда факторов: скорости и направления ветра, развития волнения, формы береговой линии, удаленности от берега источника микрочастиц, наличия высшей водной растительности и других неподвижных и плавающих предметом, к которым эти частицы могут притягиваться. До 80 % микросфер из пенополистирола, попавшие в водный объект, могут быть выброшены обратно на сушу ветровыми волнами и волнами от судов.
Работа выполнена в рамках темы №FMWZ-2022-0002 Государственного задания ИВП РАН.
Литература
- Alava J. J., Jahnke A., Bergmann M., Aguirre-Martinez G.V., Bendell L., Calle P., Dominguez G. A., Faustman E. M., Falman J., Kazmiruk T. N., Klasios N., Maldonado M. T., McMullen K., Moreno-Baez M., Öberg G., Ota Y., Price D., Shim W. J., Tirape A., Vandenberg J.M., Zoveidadianpour Z., Weis J. A call to include plastics in the global environment in the class of persistent, bioaccumulative, and toxic (PBT) pollutants // Environmental Science & Technology. 2023. Vol. 57. P. 8185-8188. DOI: 10.1021/acs.est.3c02476.
- Казмирук В. Д. Микропластик в окружающей среде: Нарастающая проблема планетарного масштаба. М.: URSS, 2020. 432 c.
- Frère L., Paul-Pont I., Rinnert E., Petton S., Jaffré J., Bihannic I., Soudant P., Lambert Ch., Huvet A. Influence of environmental and anthropogenic factors on the composition, concentration and spatial distribution of microplastics: A case study of the Bay of Brest (Brittany, France) // Environmental Pollution. 2017. Vol. 225. P. 211-222. DOI: 10.1016/j.envpol.2017.03.023.
- Van Cauwenberghe L. Devriese L., Galgani F., Robbens J., Janssen C. R. Microplastics in sediments: A review of techniques, occurence and effects // Marine Environmental Research. 2015. Vol. 111. P. 5-17. DOI: 10.1016/j.marenvres.2015.06.007.
- Van Cauwenberghe L., Vanreusel A., Mees J., Janssen C.R. Microplastic pollution in deep-sea sediments // Environmental Pollution. 2013. Vol. 182. P. 495-499. DOI: 10.1016/j.envpol.2013.08.013.
- Hidalgo-Ruz V., Gutow L., Thompson R.C., Thiel M. Microplastics in the marine environment: A review of used the methods for identification and quantification // Environmental Science and Technology. 2012. Vol. 46. P. 3060-3075. DOI: 10.1021/es2031505.
- Andrady A. L. Microplastics in the marine environment // Marine Pollution Bulletin. 2011. Vol. 62. P. 1596-1605. DOI: 10.1016/j.marpolbul.2011.05.030.
- Fazey F. M. C., Ryan P. G. Biofouling on buoyant marine plastics: An experimental study into the effect of size on surface longevity // Environmental Pollution. 2016. Vol. 210. P. 354-360. DOI: 10.1016/j.envpol.2016.01.026.
- Kaiser D., Kowalski N., Waniek J.J. Effects of biofouling on the sinking behavior of microplastics // Environmental Research Letters. 2017. Vol. 12. 124003. DOI: 10.1088/1748-9326/aa8e8b.
- Collignon A., Hecq J.-H., Glagani F., Voisin P., Collard F., Goffart A. Annual variation in neustonic micro- and meso-plastic particles and zooplankton in the Bay of Calvi (Mediterranean-Corsica) // Marine Pollution Bulletin. 2014. Vol. 79. P. 293-298. DOI: 10.1016/j.marpolbul.2013.11.023.
- Wang J., Tan Z., Peng J., Qiu Q., Li M. The behaviors of microplastics in the marine environment // Marine Environmental Research. 2016. Vol. 113. P. 7-17. DOI: 10.1016/j.marenvres.2015.10.014.
- Kooi M., van Nes E. H., Scheffer M., Koelmans A.A. Ups and downs in the Ocean: Effects of biofouling on vertical transport of microplastics // Environmental Science and Technology. 2017. Vol. 51. P. 7963-7971. DOI: 10.1021/acs.est.6b04702.
- Weinstein J. E., Crocker B. K., Gray A. D. From macroplastic to microplastic degradation of high-density polyethylene, polypropylene, and polystyrene in a salt marsh habitat // Environmental Toxicology and Chemistry. 2016. Vol. 35(7). P. 1632-1640. DOI: 10.1002/etc.3432.
- Chubarenko I., Bagaev A., Zobkov M., Esiukova E. On some physical and dynamical properties of microplastic particles in marine environment // Marine Pollution Bulletin. 2016. Vol. 108. P. 105-112. DOI: 10.1016/j.marpolbul.2016.04.048.
- Besseling E., Quik J. T. K., Sun M., Koelmans A.A. Fate of nano- and microplastic in freshwater systems: A modeling study // Environmental Pollution. 2017. Vol. 220. P. 540-548. DOI: 10.1016/j.envpol.2016.10.001.
- Andersen T. J., Rominikan S., Olsen I. S., Skinnebach K. H., Fruergaard M. Flocculation of PVC microplastic and fine-grained cohesive sediment at environmentally realistic concentrations // Biological bulletin. 2021. Vol. 240. P. 42-51. DOI: 10.1086/712929.
- Leiser L., Wu G.-M., Neu T. R., Wendt-Potthoff K. Biofouling, metal sorption and aggregation are related to sinking of microplastics in a stratified reservoir // Water Research. 2020. Vol. 176. 115748. DOI: 10.1016/j.watres.2020.115748.
- Lagarde F., Olivier O., Zanella M., Daniel P., Hiard S., Caruso A. Microplastic interactions with freshwater microalgae: Heteroaggregation and changes in plastic density appear strongly dependent on polymer type // Environmental Pollution. 2016. Vol. 215. P. 331-339. DOI: 10.1016/j.envpol.2016.05.006.
- Yan M., Wang L., Dai Y., Sun H., Liu Ch. Behavior of microplastics in inland waters: Aggregation, settlement, and transport // Bulletin of Environmental Contamination and Toxicology. 2021. V. 107. P. 700-709. DOI: 10.1007/s00128-020-03087-2.
- Hakim A., Kobayashi M. Aggregation and aggregate strength of microscale plastic particles in the presence of natural organic matter: Effects of ionic valence // Journal of Polymers and the Environment. 2021. Vol. 29. P. 1921-1929. DOI: 10.1007/s10924-020-01985-4.
- Казмирук В. Д. Барьерная роль макрофитов при загрязнении водных объектов микропластиком // Наука. Инновации. Технологии. 2021. №3. С. 133-149.
- Eitzen L., Paul S., Braun U., Altmann K., Jekel M., Ruhl A. S. The challenge in preparing particle suspensions for aquatic microplastic research // Environmental Research. 2019. Vol. 168. P. 490-495. DOI: 10.1016/j.envres.2018.09.008.
- Di M., Liu L., Wang W., Wang J. Manuscript prepared for submission to environmental toxicology and pharmacology pollution in drinking water source areas: Microplastics in the Danjiangkou Reservoir, China // Environmental Toxicology and Pharmacology. 2019. Vol. 65. P. 82-89. DOI: 10.1016/j.etap.2018.12.009.
- Bai Z., Wang N., Wang M. Effects of microplastics on marine copepods // Ecotoxicology and Environmental Safety 2021. Vol. 217. 112243. DOI: 10.1016/j.ecoenv.2021.112243.
- Kukkola A., Krause S., Lynch I., Sambrook Smith G.H., Nel H. Nano and microplastic interactions with freshwater biota – Current knowledge, challenges and future solutions // Environment International. 2021. Vol. 152. 106504. DOI: 10.1016/j.envint.2021.106504.
- Sendra M., Sparaventi E., Novoa B., Figuera A. An overview of the internalization and effects of microplastics and nanoplastics as pollutants of emerging concern in bivalves // Science of the Total Environment. 2021. Vol. 753. 142024. DOI: 10.1016/j.scitotenv.2020.142024.
- Казмирук В.Д., Звезденкова Г.А. Микропластик в прибрежной полосе: скорость и факторы попадания в водный объект // Геополитика и экогеодинамика регионов. 2021. Т. 7, № 4. С. 249-256.
- Geyer R., Jambeck J. R., Law K. L. Production, use, and fate of all plastics ever made // Science Advances. 2017. Vol. 3. e1700782. DOI: 10.1126/sciadv.1700782.
- Kukulka T., Law K.L., Proskurowski G. Evidence for the influence of surface heat fluxes on turbulent mixing of microplastic marine debris // Journal of Physical Oceanography. 2016. Vol. 46. P. 809-815. DOI: 10.1175/JPO-D-15-0242.1.
- Claessens M., Van Cauwenberghe L., Vandegehuchte M.B., Janssen C.R. New techniques for the detection of microplastics in sediments and field collected organisms // Marine Pollution Bulletin. 2013. Vol. 70. P. 227-233. DOI: 10.1016/j.marpolbul.2013.03.009.
- Казмирук В. Д. Механизмы перехвата пластиковых микрочастиц буферными зонами из макрофитов // Геосистемы переходных зон. 2021. Т. 5, № 4. С. 378-388. DOI: 10.30730/gtrz.2021.5.4.378-388.
|
V. D. Kazmiruk |
Some features of the behavior of plastic microparticles (microplastics) in natural waters |
|
Water Problems Institute of RAS, Moscow e-mail: kazm@iwp.ru |
Abstract. A number of features of the behavior of plastic microparticles in natural waters have been identified and possible mechanisms causing this behavior have been analyzed. It has been established that particles made of polyethylene, the initial density of which is less than the density of water, already after 15-47 hours of being on its surface, begin to sink into the water column as a result of the addition of mineral and organic particles found in natural waters. Microflakes made of polyethylene terephthalate, having a density higher than the density of water, can remain on its surface for a long time, supported by surface tension forces.
Keywords: microplastics, water body, behavior, experiment, polyethylene, polyethylene terephthalate, expanded polystyrene
References
- Alava J. J., Jahnke A., Bergmann M., Aguirre-Martinez G.V., Bendell L., Calle P., Dominguez G. A., Faustman E. M., Falman J., Kazmiruk T. N., Klasios N., Maldonado M. T., McMullen K., Moreno-Baez M., Öberg G., Ota Y., Price D., Shim W. J., Tirape A., Vandenberg J. M., Zoveidadianpour Z., Weis J. A call to include plastics in the global environment in the class of persistent, bioaccumulative, and toxic (PBT) pollutants // Environmental Science & Technology. 2023. Vol. 57. P. 8185-8188. DOI: 10.1021/acs.est.3c02476. (In English)
- Kazmiruk V. D. Mikroplastik v okruzhayushchej srede: Narastayushchaya problema planetarnogo masshtaba. M.: URSS, 2020. 432 s. (In Russian)
- Frère L., Paul-Pont I., Rinnert E., Petton S., Jaffré J., Bihannic I., Soudant P., Lambert Ch., Huvet A. Influence of environmental and anthropogenic factors on the composition, concentration and spatial distribution of microplastics: A case study of the Bay of Brest (Brittany, France) // Environmental Pollution. 2017. Vol. 225. P. 211-222. DOI: 10.1016/j.envpol.2017.03.023. (In English)
- Van Cauwenberghe L. Devriese L., Galgani F., Robbens J., Janssen C. R. Microplastics in sediments: A review of techniques, occurence and effects // Marine Environmental Research. 2015. Vol. 111. P. 5-17. DOI: 10.1016/j.marenvres.2015.06.007. (In English)
- Van Cauwenberghe L., Vanreusel A., Mees J., Janssen C.R. Microplastic pollution in deep-sea sediments // Environmental Pollution. 2013. Vol. 182. P. 495-499. DOI: 10.1016/j.envpol.2013.08.013. (In English)
- Hidalgo-Ruz V., Gutow L., Thompson R.C., Thiel M. Microplastics in the marine environment: A review of used the methods for identification and quantification // Environmental Science and Technology. 2012. Vol. 46. P. 3060-3075. DOI: 10.1021/es2031505. (In English)
- Andrady A.L. Microplastics in the marine environment // Marine Pollution Bulletin. 2011. Vol. 62. P. 1596-1605. DOI: 10.1016/j.marpolbul.2011.05.030. (In English)
- Fazey F. M. C., Ryan P. G. Biofouling on buoyant marine plastics: An experimental study into the effect of size on surface longevity // Environmental Pollution. 2016. Vol. 210. P. 354-360. DOI: 10.1016/j.envpol.2016.01.026. (In English)
- Kaiser D., Kowalski N., Waniek J. J. Effects of biofouling on the sinking behavior of microplastics // Environmental Research Letters. 2017. Vol. 12. 124003. DOI: 10.1088/1748-9326/aa8e8b. (In English)
- Collignon A., Hecq J.-H., Glagani F., Voisin P., Collard F., Goffart A. Annual variation in neustonic micro- and meso-plastic particles and zooplankton in the Bay of Calvi (Mediterranean-Corsica) // Marine Pollution Bulletin. 2014. Vol. 79. P. 293-298. DOI: 10.1016/j.marpolbul.2013.11.023. (In English)
- Wang J., Tan Z., Peng J., Qiu Q., Li M. The behaviors of microplastics in the marine environment // Marine Environmental Research. 2016. Vol. 113. P. 7-17. DOI: 10.1016/j.marenvres.2015.10.014. (In English)
- Kooi M., van Nes E.H., Scheffer M., Koelmans A.A. Ups and downs in the Ocean: Effects of biofouling on vertical transport of microplastics // Environmental Science and Technology. 2017. Vol. 51. P. 7963-7971. DOI: 10.1021/acs.est.6b04702. (In English)
- Weinstein J. E., Crocker B. K., Gray A. D. From macroplastic to microplastic degradation of high-density polyethylene, polypropylene, and polystyrene in a salt marsh habitat // Environmental Toxicology and Chemistry. 2016. Vol. 35(7). P. 1632-1640. DOI: 10.1002/etc.3432. (In English)
- Chubarenko I., Bagaev A., Zobkov M., Esiukova E. On some physical and dynamical properties of microplastic particles in marine environment // Marine Pollution Bulletin. 2016. Vol. 108. P. 105-112. DOI: 10.1016/j.marpolbul.2016.04.048. (In English)
- Besseling E., Quik J. T. K., Sun M., Koelmans A.A. Fate of nano- and microplastic in freshwater systems: A modeling study // Environmental Pollution. 2017. Vol. 220. P. 540-548. DOI: 10.1016/j.envpol.2016.10.001. (In English)
- Andersen T. J., Rominikan S., Olsen I. S., Skinnebach K. H., Fruergaard M. Flocculation of PVC microplastic and fine-grained cohesive sediment at environmentally realistic concentrations // Biological bulletin. 2021. Vol. 240. P. 42-51. DOI: 10.1086/712929. (In English)
- Leiser L., Wu G.-M., Neu T. R., Wendt-Potthoff K. Biofouling, metal sorption and aggregation are related to sinking of microplastics in a stratified reservoir // Water Research. 2020. Vol. 176. 115748. DOI: 10.1016/j.watres.2020.115748. (In English)
- Lagarde F., Olivier O., Zanella M., Daniel P., Hiard S., Caruso A. Microplastic interactions with freshwater microalgae: Heteroaggregation and changes in plastic density appear strongly dependent on polymer type // Environmental Pollution. 2016. Vol. 215. P. 331-339. DOI: 10.1016/j.envpol.2016.05.006. (In English)
- Yan M., Wang L., Dai Y., Sun H., Liu Ch. Behavior of microplastics in inland waters: Aggregation, settlement, and transport // Bulletin of Environmental Contamination and Toxicology. 2021. V. 107. P. 700-709. DOI: 10.1007/s00128-020-03087-2. (In English)
- Hakim A., Kobayashi M. Aggregation and aggregate strength of microscale plastic particles in the presence of natural organic matter: Effects of ionic valence // Journal of Polymers and the Environment. 2021. Vol. 29. P. 1921-1929. DOI: 10.1007/s10924-020-01985-4. (In English)
- Kazmiruk V. D. Bar’ernaya rol’ makrofitov pri zagryaznenii vodnyh ob”ektov mikroplastikom // Nauka. Innovacii. Tekhnologii. 2021. №3. S. 133-149. (In Russian)
- Eitzen L., Paul S., Braun U., Altmann K., Jekel M., Ruhl A. S. The challenge in preparing particle suspensions for aquatic microplastic research // Environmental Research. 2019. Vol. 168. P. 490-495. DOI: 10.1016/j.envres.2018.09.008. (In English)
- Di M., Liu L., Wang W., Wang J. Manuscript prepared for submission to environmental toxicology and pharmacology pollution in drinking water source areas: Microplastics in the Danjiangkou Reservoir, China // Environmental Toxicology and Pharmacology. 2019. Vol. 65. P. 82-89. DOI: 10.1016/j.etap.2018.12.009. (In English)
- Bai Z., Wang N., Wang M. Effects of microplastics on marine copepods // Ecotoxicology and Environmental Safety 2021. Vol. 217. 112243. DOI: 10.1016/j.ecoenv.2021.112243. (In English)
- Kukkola A., Krause S., Lynch I., Sambrook Smith G. H., Nel H. Nano and microplastic interactions with freshwater biota – Current knowledge, challenges and future solutions // Environment International. 2021. Vol. 152. 106504. DOI: 10.1016/j.envint.2021.106504. (In English)
- Sendra M., Sparaventi E., Novoa B., Figuera A. An overview of the internalization and effects of microplastics and nanoplastics as pollutants of emerging concern in bivalves // Science of the Total Environment. 2021. Vol. 753. 142024. DOI: 10.1016/j.scitotenv.2020.142024. (In English)
- Kazmiruk V. D., Zvezdenkova G. A. Mikroplastik v pribrezhnoj polose: skorost’ i faktory popadaniya v vodnyj ob”ekt // Geopolitika i ekogeodinamika regionov. 2021. T. 7, № 4. S. 249-256. (In Russian)
- Geyer R., Jambeck J. R., Law K. L. Production, use, and fate of all plastics ever made // Science Advances. 2017. Vol. 3. e1700782. DOI: 10.1126/sciadv.1700782. (In English)
- Kukulka T., Law K.L., Proskurowski G. Evidence for the influence of surface heat fluxes on turbulent mixing of microplastic marine debris // Journal of Physical Oceanography. 2016. Vol. 46. P. 809-815. DOI: 10.1175/JPO-D-15-0242.1. (In English)
- Claessens M., Van Cauwenberghe L., Vandegehuchte M.B., Janssen C.R. New techniques for the detection of microplastics in sediments and field collected organisms // Marine Pollution Bulletin. 2013. Vol. 70. P. 227-233. DOI: 10.1016/j.marpolbul.2013.03.009. (In English)
- Kazmiruk V. D. Mekhanizmy perekhvata plastikovyh mikrochastic bufernymi zonami iz makrofitov // Geosistemy perekhodnyh zon. 2021. T. 5, № 4. S.378-388. DOI: 10.30730/gtrz.2021.5.4.378-388. (In Russian)
Поступила в редакцию 01.05.2024 г.



